近日,中国海洋大学海洋化学理论与工程技术教育部重点实验室/化学化工学院仇萌教授团队在Nature Index期刊Nano Letters上发表了题为“Near-Infrared Photothermal-Pyroelectric Coupling (PTPC)-Activated Trace Element Prodrug Nanoplatform for Tumor Specific Immune Modulation and Therapy”的最新研究成果。该研究将纳米生物光子学与微量元素精准治疗深度融合,在光调控纳米医学领域取得了重要进展。
微量元素虽“量少”,但在生命活动中发挥关键调控功能,具有抑制肿瘤迁移(Zn)、诱导氧化损伤(Fe)、增强免疫反应(Mn)、抑制肿瘤血管生成(Sb)等多重抗癌机制。其中,硒(Se)因可诱导肿瘤细胞凋亡、抑制转移并重塑免疫微环境而备受关注。然而,传统硒制剂存在生物利用度低、体内释放不可控、毒性窗口窄等问题,一直难以突破。
二维黑磷因其可降解性、生物相容性及灵活可设计性,被视为新一代生物光子材料。其独特的光热–热释电特性使其在近红外脉冲光照射下能够产生大量活性氧(ROS),实现材料的快速可控降解,因而是理想的“光控”药物释放载体。团队利用化学气相输运(CVT)法制备出原子级均匀硒掺杂黑磷纳米片(Se-BP)。这种方式不仅保持了黑磷晶格结构完整性,还可引入多种治疗性微量元素(As、Bi、Te等),为未来的“可定制微量元素治疗”提供技术路径。在脉冲近红外光照射下,Se-BP 将光热能转化为热释电电流,触发局部 ROS 生成,进而实现材料的时空精准降解与按需释放。释放出来的 Se 会进一步氧化为具有强细胞毒性的亚硒酸盐,可高效诱导癌细胞凋亡并抑制转移。值得关注的是,该研究进一步揭示了光子激活硒释放对肿瘤免疫系统的强效调节作用,包括:促进 T 细胞浸润、驱动巨噬细胞向抗肿瘤型 M1 表型转化、显著增强免疫检查点抑制剂的治疗敏感性。这种基于光控能量转化的免疫调节策略,是纳米生物光子学在医学领域的重要延伸。
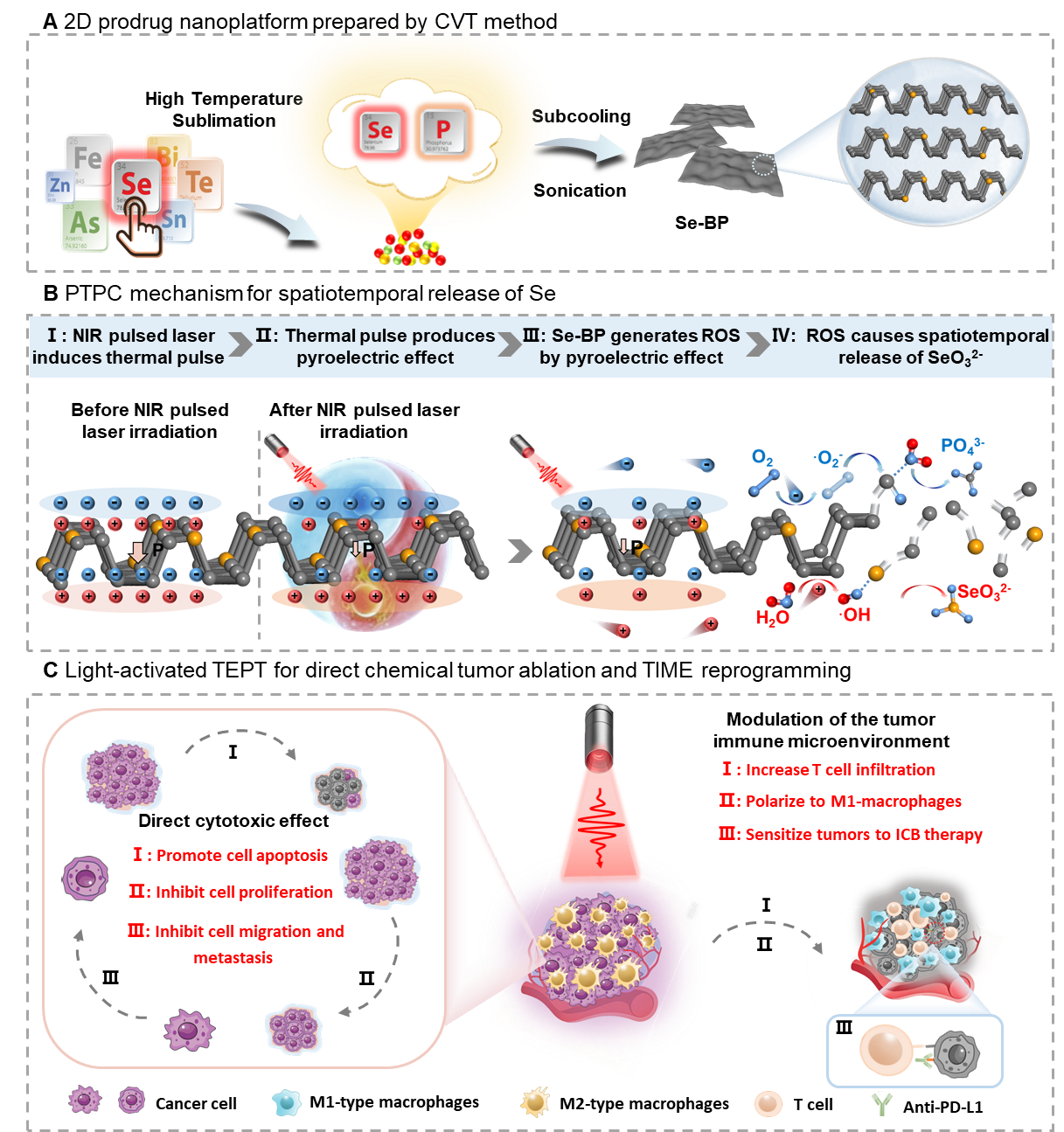
图1 纳米光子学精准治疗平台构建与工作原理示意图
论文第一完成单位为中国海洋大学海洋化学理论与工程技术教育部重点实验室/化学化工学院。通讯作者为复旦大学杨云龙教授、深圳大学张晗教授和中国海洋大学仇萌教授。第一作者为中国海洋大学 2021 级博士生张一凡和博士后惠天琨。该研究得到了国家自然科学基金、山东省自然科学基金、山东省泰山学者项目以及中央高校基本科研经费项目的支持。

仇萌教授课题组成员(第一排右一为张一凡)



